Het ontstaan van tumoren
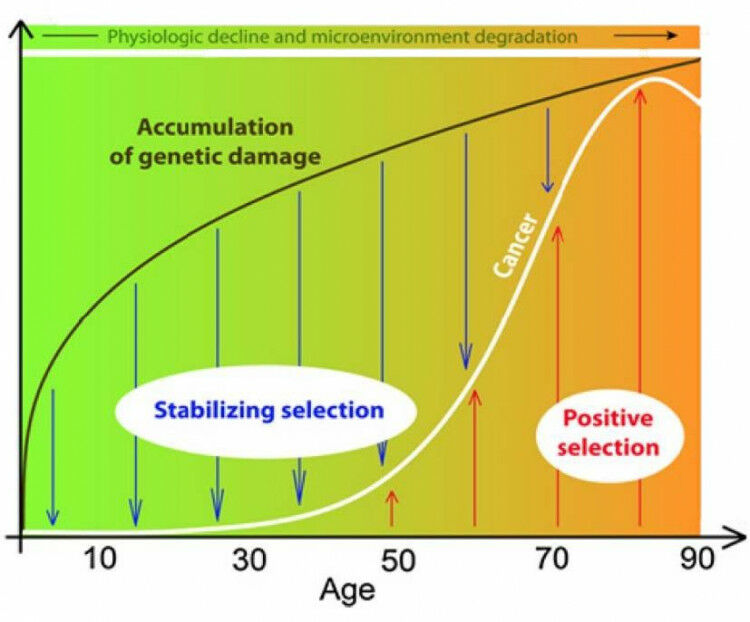
Kanker, het is een ziekte waar zo goed als ieder van ons mee geconfronteerd wordt. Waarom ontwikkelt de ene persoon nu net wel kanker en de andere niet? Afschrijven aan het toeval lijkt wat kort door de bocht. DNA-mutaties (zgn. foutjes in het DNA) worden vaak naar voren geschoven als boosdoener, maar elk van ons wordt voortdurend geconfronteerd met DNA mutaties. Zelfs nog voor ons 30ste levensjaar. Waarom krijgt dan niet iedereen kanker en waarom komt kanker vaak pas op latere leeftijd voor? Het is duidelijk dat meerdere factoren een rol spelen, waaronder de micro-omgeving van de tumorcel.
De rol van het methylgroep metabolisme
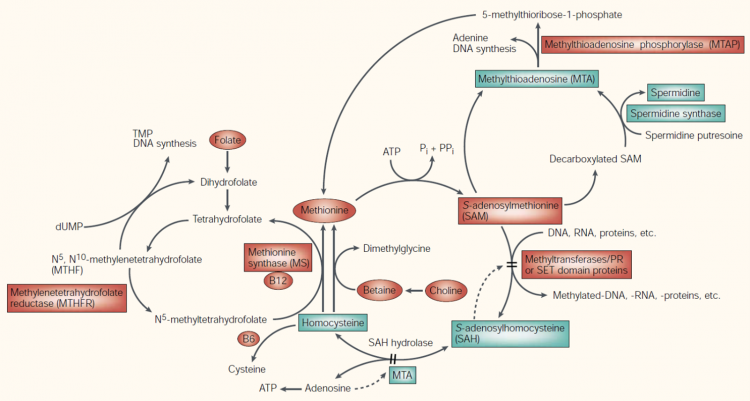
Methylatie is een reactie dat in de cellen plaatsvindt en een complexe chemische uitleg heeft. Het zorgt ervoor dat bepaalde metabolieten worden uitgescheden, wat er concreet op neerkomt dat Methylatie uiterst belangrijk is om toxische (giftige) stoffen uit het lichaam te verwijderen. Daarnaast zijn methylatiereaties ook belangrijk in andere fysiologische processen zoals het beschermen van de genen, immuniteit, neurologische functies en het stimuleren van de leverontgifting.
In bepaalde omstandigheden, wanneer bv. teveel toxines in het bloed aanwezig zijn of bij langdurige stress, is de methylatiecapaciteit van het lichaam ontoereikend om alle metabole reacties uit te voeren. Het lichaam maakt keuzes en zal daarom bepaalde reacties links laten liggen. Dit kan leiden tot een opstapeling van toxines, verstoringen in de regeling van DNA expressie, verminderde bescherming van specifieke genen, verstoring van de leverontgifting… Kortom: alle reacties waar methylatie een cruciale rol in speelt. Defecten in het methylgroep metabolisme kunnen dus geassocieerd worden met een verhoogd risico op het ontwikkelen van kanker.
Maar hoe pak je dit dan best concreet aan?
Methylatie kan enkel plaatsvinden door het aanreiken van de juiste stoffen: choline, betaïne, methionine en B-vitamines (B6, B12 en foliumzuur) zijn hierbij uitermate belangrijk. Bij kanker zien we dat deze voedingsstoffen vaak in abnormaal lage hoeveelheden aanwezig zijn bij kanker en lage levels of tekorten ervan worden op hun beurt gelinkt met het ontstaan van humane kankers.
Behandelingen, nieuwe ontwikkelingen en de zoektocht naar alternatieven
Huidige therapieën richten zich op het tegenhouden van de groei of elimineren van de kankercellen. Hierbij worden gezonde cellen getroffen en de omgeving wordt er niet beter op, integendeel. De echte oorzaak van de tumoren wordt genegeerd en de kans op herval is vaak groot.
Het onderzoek naar kankertherapieën is de laatste jaren exponentieel toegenomen. Van 68 nieuwe anti-kanker geneesmiddelen die tussen 2009 en 2013 werden goedgekeurd kon voor 42 van deze geen verbetering van de overleving worden aangetoond na een follow-up periode van 5,4 jaar. Van de middelen die wel een voordeel leken te bieden was de gemiddelde winst in overleving nog geen 3 maanden. 11 middelden leverden een klinisch voordeel op en slechts 2 verbeteren effectief de levenskwaliteit van de patiënt. Dure behandelingen, valse hoop en onnodige bijwerkingen, voor weinig efficiëntie in ruil.
Patiënten gaan zelf op zoek naar manieren om de geneeskans te vergroten. Om die reden neemt naar schatting 80% van de kankerpatiënten daarom voedingssupplementen in. De objecties die artsen vaak ten onrechte of uit ongefundeerde hoek hebben over voedingssupplementen zorgt ervoor dat veel patiënten dit gebruik niet aan hun arts meedelen. De patiënt neemt dus maar iets, wat mogelijks niet opportuun is bij de behandeling. Het is om die reden dan ook essentieel dat artsen, met de nodige kennis over wat wél aangewezen en zinvol is, net zouden toezien op het correct gebruik van natuurlijke middelen bij kanker. Alleen zo kan de kankertherapie op een efficiënte en wetenschappelijke manier ondersteund worden en kunnen bijwerkingen mogelijks verminderd worden.
Behandeling met natuurlijke stoffen: hoe dit gericht, wetenschappelijk en veilig aanpakken?
Zoals voordien uitgestippeld, richten huidige therapieën bij allerhande ziektes zich steeds op de behandeling van de symptomen, zonder de oorzaak van de ziekte te behandelen die in het lichaam aanwezig kan zijn. Het niet aanpakken van bv. een darmprobleem die aan de oorzaak ligt van een bepaalde ziekte, kan dit leiden tot het ontwikkelen van andere chronische ziektes. Deze ziektes worden in werkelijkheid bijna nooit gelinkt aan in dit geval het darmprobleem dat aan de oorzaak ligt van deze chronische ziekte. Dit legt uit waarom het zo belangrijk is om onderliggende oorzaken op te sporen en te herstellen, voor deze nog meer schade kunnen aanrichten. Twee belangrijke hoofdsystemen liggen hiervoor aangewend worden.
- Enerzijds is de opname van nutriënten en de eliminatie van toxische stoffen enorm belangrijk. De darmen en lever spelen hierbij de grootste rol.
- Anderzijds kan chronische stress, door constante aanmaak van adrenaline en cortisol, leiden tot uitputting van het lichaam en detoxificatie(ontgiftings-)problemen.
Ook bij kanker is het belangrijk om deze twee hoofdsystemen te ondersteunen. Het darmslijmvlies en het darmmicrobioom (het geheel van alle goede en slechte bacteriën die leven in je darm) zijn hierbij essentieel. Samen zorgen deze namelijk voor een selectieve doorlaatbaarheid van de darm, wat zich uit in een efficiënte absorptie van voedingsstoffen en uitscheiding van afvalstoffen. Daarnaast is het herstel van chronische ontstekingen en de energieleverende functie van de cel (mitochondriale functie) een belangrijk punt. Hierbij zijn, zoals reeds vermeld, de lever (reinigingsfunctie) en de behandeling van chronische ontstekingen en chronische stress essentieel. Ten slotte is hier ook ondersteuning van de methylatie capaciteit van groot belang. Dit kan perfect via de voeding.